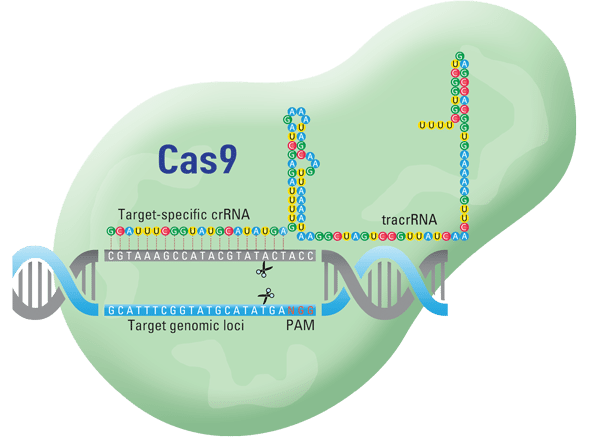
A Technocracy News & Trends prémium szolgáltatások csak Premium Access tagoknak szólnak. Nézd meg!
Kapcsolódó cikkek: